十多年来,我们建立和优化了免疫治疗抗体技术平台 (iTAb
TM),并拥有一系列国内国际专利。该技术平台利用T细胞衔接器 ( T cell engager)原理,产生双特异性和多特异性抗体。该抗体的一端靶向结合肿瘤相关抗原(TAA),或肿瘤特异抗原(TSA),抗体的另一端特异衔接T细胞,从而激活T细胞并杀死癌细胞,达到清除靶细胞,治疗肿瘤患者的目标。
iTAb
TM双/三特异性抗体分子通过结合靶细胞表面的抗原表位(包括TAA和TSA),并衔接肿瘤病人体内的T细胞,在T细胞和肿瘤细胞之间形成免疫突触。T细胞活化并释放穿孔素,颗粒酶等,杀死肿瘤细胞。一个激活后的T细胞可以连续杀死多个肿瘤靶细胞。在双/多特异性抗体药物的作用下,T细胞可以持续增殖,发挥长期的抗肿瘤活性。
iTAb
TM双/三特异抗体分子的优势在于其强大的T细胞衔接器功能,具有超强的生物学活性。对表达肿瘤相关抗原的癌细胞,与传统的抗肿瘤抗体药物相比,iTAb
TM双抗体分子具有10
3 – 10
6 倍的生物学活性。iTAb
TM抗体分子还可识别肿瘤抗原表达超低水平的靶细胞,即每个细胞几个到几千个表面抗原分子(表达肿瘤特异抗原的癌细胞,或肿瘤干细胞),并激活T细胞进而杀死肿瘤细胞。iTAb
TM双/三特异性抗体分子不含有Fc 片段,从生物学上避免了Fc带来的潜在脱靶副作用,而保持了T细胞衔接器功能。同时,iTAb
TM抗体分子具有简化后的抗体样结构,成药性高,分子对称,表达高效,工艺成熟,产品显示出超长的稳定性,从而具有产业化低成本生产优势。
公司的多个产品目前已进入临床前或临床研究阶段。
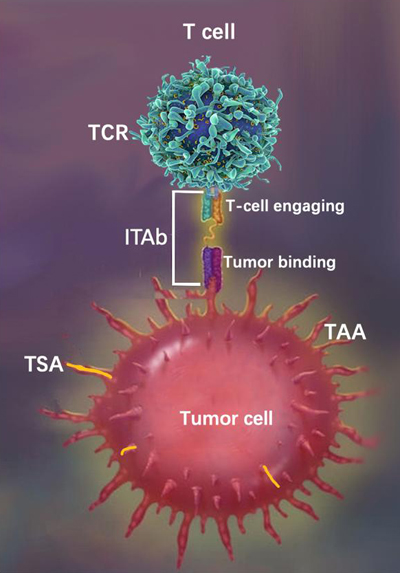
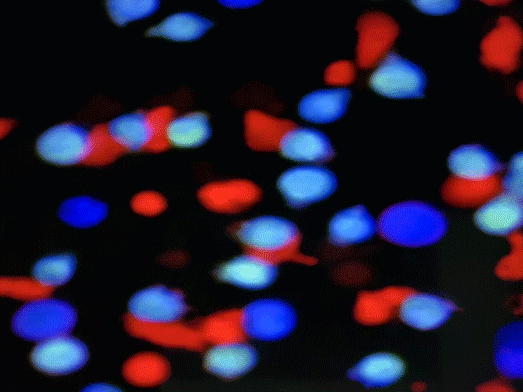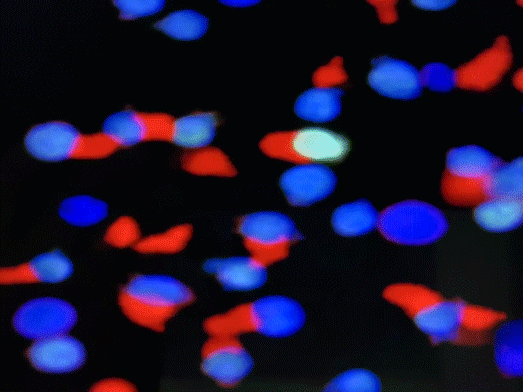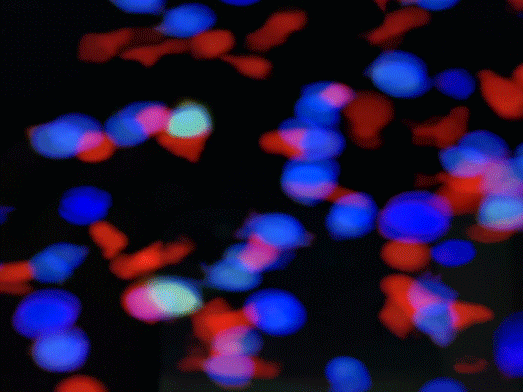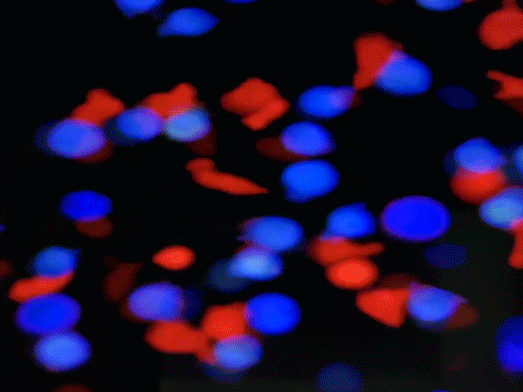
免疫抗体ITAb的作用机理。iTAb
TM: Immunotherapy antibody; TCR: T cell receptor; TAA: Tumor associated antigen; TSA: Tumor specific antigen.
专利授权保护的iTAb
TM分子结构如下图所示:
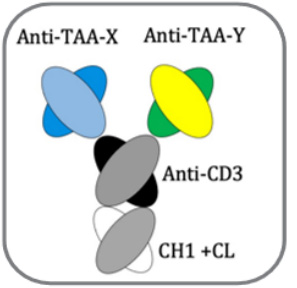
X,Y 可以代表两个不同的TAA. X=Y 时,代表同一个TAA.
iTAb
TM的结构优势:
人源化的CD3抗体,与猴和人均交叉反应,亲和力相近。
可以同时结合两个相同,或不同的抗原决定簇。
具有超强的杀死肿瘤靶细胞的生物活性(EC
50 fM–pM)。
可有效地进入实体瘤内并引起瘤内侵润T细胞的聚集。
在食蟹猴体内显示良好的半衰期和药效 。
早期临床数据显示,iTAb
TM分子在治疗癌症患者过程中,比BiTE具有更大的安全窗和更低的细胞因子释放水平。
iTAb
TM产品由CHO细胞表达,具有稳健的生产工艺,200L规模可满足商业化生产需求。液体制剂稳定性良好,临床试验样品在2-8℃保存6年后,依然符合质量标准。
T 细胞衔接器
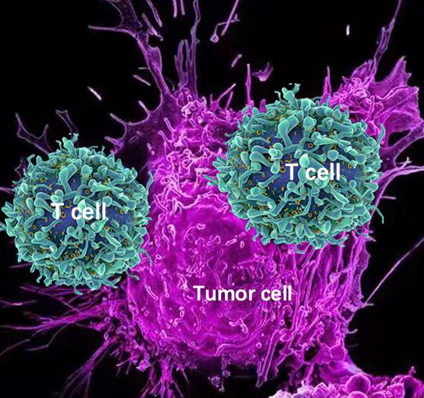
T细胞攻击肿瘤细胞示意图:当T细胞与肿瘤细胞通过T细胞衔接器结合后,T细胞激活,攻击和杀死肿瘤细胞。
20世纪50年代末,Burnet和 Thomas提出肿瘤免疫监测理论,认为免疫系统可以识别和杀死新生的癌细胞。在以后的几十年,这个理论逐渐在肿瘤生物学,动物模型和临床得到证实。近年来,免疫疗法发展迅速,给癌症患者带来了前所未有的治疗效果。特别是基于T细胞的TCE(T cell engager)疗法,其原理是T 细胞通过特定方式衔接于肿瘤靶细胞,同时激活T细胞,使其裂解靶细胞。正由于此,《科学》杂志在2013年将癌症免疫疗法确认为当年度的科学突破。
T细胞衔接靶细胞的方式主要有两种:1. 抗体,即双或多特异性抗体;2. 改造过的T 细胞,包括 CAR-T 细胞(Chimeric Antigen Receptor T cells,CAR-T)和TCR-T细胞(T cell receptor T cells,TCR-T) 。 它们的相同点是都利用了体内具有强大杀伤能力的T细胞。双或多特异性抗体和CAR-T,都突破了MHC分子限制。TCE的作用机制是,一旦T细胞衔接上靶细胞,即在两个细胞间形成免疫突触,T细胞释放颗粒酶、穿孔素等,裂解靶细胞。
iTAbTM 可能解决肿瘤免疫治疗的两大挑战:抗原逃逸和T细胞耗竭
抗原逃逸
在针对单靶点(CD19, BCMA, CD20等)的免疫治疗包括细胞治疗和抗体药物,在临床治疗中往往会发生不同程度的耐药而导致肿瘤复发。产生耐药的主要机理之一是抗原逃逸,又叫靶标丢失(或下调)。 iTAb分子可以同时靶向两个或多个抗原,从而避免单靶点的抗原逃逸,达到更加有效清除癌细胞的结果,降低耐药和复发。
T细胞耗竭
在癌症的病变和治疗过程中,T细胞(杀伤T细胞)往往会发生不同程度的功能障碍。 目前CART细胞治疗和T细胞激活的双抗体疗法,尚未实现治疗实体瘤的突破。原因之一,可能是杀伤性T细胞的功能障碍并没有得到解决,或者是杀伤性T细胞激活不够;原因之二,可能是患者体内的细胞长时间暴露在药物的刺激下,导致T细胞耗竭。选择性激活CD8细胞的iTAb分子可特异激活杀伤性T细胞。同时,结合“打了就跑 (hit-and-run)” 的给药模式,可能避免或降低T细胞耗竭,达到更好的临床疗效,治愈许多的癌症患者的目的。

 十多年来,我们建立和优化了免疫治疗抗体技术平台 (iTAbTM),并拥有一系列国内国际专利。该技术平台利用T细胞衔接器 ( T cell engager)原理,产生双特异性和多特异性抗体。该抗体的一端靶向结合肿瘤相关抗原(TAA),或肿瘤特异抗原(TSA),抗体的另一端特异衔接T细胞,从而激活T细胞并杀死癌细胞,达到清除靶细胞,治疗肿瘤患者的目标。
十多年来,我们建立和优化了免疫治疗抗体技术平台 (iTAbTM),并拥有一系列国内国际专利。该技术平台利用T细胞衔接器 ( T cell engager)原理,产生双特异性和多特异性抗体。该抗体的一端靶向结合肿瘤相关抗原(TAA),或肿瘤特异抗原(TSA),抗体的另一端特异衔接T细胞,从而激活T细胞并杀死癌细胞,达到清除靶细胞,治疗肿瘤患者的目标。 





